ผู้เขียน:
Florence Bailey
วันที่สร้าง:
21 มีนาคม 2021
วันที่อัปเดต:
1 กรกฎาคม 2024
เนื้อหา
- ขั้นตอน
- วิธีที่ 1 จาก 2: การกระจายของอิเล็กตรอนโดยใช้ระบบธาตุของ D.I. Mendeleev
- วิธีที่ 2 จาก 2: การใช้ตารางธาตุ ADOMAH
- เคล็ดลับ
การกำหนดค่าอิเล็กทรอนิกส์ อะตอมเป็นตัวแทนเชิงตัวเลขของออร์บิทัลของอิเล็กตรอน ออร์บิทัลอิเล็กทรอนิกส์เป็นบริเวณของรูปทรงต่างๆ ที่ตั้งอยู่รอบนิวเคลียสของอะตอมซึ่งอิเล็กตรอนมีความน่าจะเป็นทางคณิตศาสตร์ การกำหนดค่าทางอิเล็กทรอนิกส์ช่วยให้บอกผู้อ่านได้อย่างรวดเร็วและง่ายดายว่าอะตอมมีออร์บิทัลอิเล็กตรอนกี่ตัว รวมทั้งกำหนดจำนวนอิเล็กตรอนในแต่ละออร์บิทัล หลังจากอ่านบทความนี้ คุณจะเข้าใจวิธีการสร้างการกำหนดค่าทางอิเล็กทรอนิกส์
ขั้นตอน
วิธีที่ 1 จาก 2: การกระจายของอิเล็กตรอนโดยใช้ระบบธาตุของ D.I. Mendeleev
 1 หาเลขอะตอมของอะตอมของคุณ แต่ละอะตอมมีจำนวนอิเล็กตรอนที่เกี่ยวข้องกัน ค้นหาสัญลักษณ์อะตอมของคุณในตารางธาตุ เลขอะตอมเป็นจำนวนเต็มบวกเริ่มต้นที่ 1 (สำหรับไฮโดรเจน) และเพิ่มขึ้นทีละหนึ่งสำหรับอะตอมที่ตามมาแต่ละอะตอม เลขอะตอมคือจำนวนโปรตอนในอะตอม ดังนั้นจึงเป็นจำนวนอิเล็กตรอนในอะตอมที่มีประจุเป็นศูนย์ด้วย
1 หาเลขอะตอมของอะตอมของคุณ แต่ละอะตอมมีจำนวนอิเล็กตรอนที่เกี่ยวข้องกัน ค้นหาสัญลักษณ์อะตอมของคุณในตารางธาตุ เลขอะตอมเป็นจำนวนเต็มบวกเริ่มต้นที่ 1 (สำหรับไฮโดรเจน) และเพิ่มขึ้นทีละหนึ่งสำหรับอะตอมที่ตามมาแต่ละอะตอม เลขอะตอมคือจำนวนโปรตอนในอะตอม ดังนั้นจึงเป็นจำนวนอิเล็กตรอนในอะตอมที่มีประจุเป็นศูนย์ด้วย - 2 กำหนดประจุของอะตอม อะตอมเป็นกลางจะมีจำนวนอิเล็กตรอนเท่ากันตามตารางธาตุ อย่างไรก็ตาม อะตอมที่มีประจุจะมีอิเลคตรอนมากหรือน้อย ขึ้นอยู่กับปริมาณของประจุ หากคุณกำลังทำงานกับอะตอมที่มีประจุ ให้บวกหรือลบอิเล็กตรอนดังนี้: เพิ่มอิเล็กตรอนหนึ่งตัวสำหรับประจุลบทุกประจุและลบหนึ่งตัวสำหรับประจุบวกทุกตัว
- ตัวอย่างเช่น อะตอมโซเดียมที่มีประจุ -1 จะมีอิเล็กตรอนพิเศษ นอกจากนี้ ถึงเลขอะตอมฐาน 11 กล่าวอีกนัยหนึ่งอะตอมทั้งหมดจะมี 12 อิเล็กตรอน
- หากเรากำลังพูดถึงโซเดียมอะตอมที่มีประจุ +1 ต้องลบอิเล็กตรอนหนึ่งตัวออกจากเลขอะตอมฐาน 11 ดังนั้นอะตอมจะมีอิเล็กตรอน 10 ตัว
- 3 จำรายการพื้นฐานของออร์บิทัล เมื่อจำนวนอิเล็กตรอนเพิ่มขึ้น พวกมันจะเติมระดับย่อยต่างๆ ของเปลือกอิเล็กตรอนของอะตอมตามลำดับที่แน่นอน แต่ละระดับย่อยของเปลือกอิเล็กตรอน เมื่อเติม จะมีอิเล็กตรอนเป็นจำนวนคู่ มีระดับย่อยต่อไปนี้:
- s-sublevel (ตัวเลขใดๆ ในรูปแบบอิเล็กทรอนิกส์ที่มาก่อนตัวอักษร "s") มีออร์บิทัลเดียวและตาม หลักการของเปาลี, หนึ่งออร์บิทัลสามารถบรรจุอิเลคตรอนได้สูงสุด 2 ตัว ดังนั้นจึงสามารถมีอิเล็กตรอนได้ 2 ตัวในแต่ละ s-sublevel ของเปลือกอิเล็กตรอน
- p-sublevel ประกอบด้วยออร์บิทัล 3 ออร์บิทัล ดังนั้นจึงมีอิเลคตรอนได้สูงสุด 6 ตัว
- d-sublevel ประกอบด้วยออร์บิทัล 5 ออร์บิทัล จึงสามารถมีอิเล็กตรอนได้มากถึง 10 อิเล็กตรอน
- f-sublevel ประกอบด้วยออร์บิทัล 7 ออร์บิทัล จึงสามารถมีอิเล็กตรอนได้มากถึง 14 อิเล็กตรอน
- g-, h-, i- และ k-sublevels เป็นทฤษฎี ไม่ทราบอะตอมที่มีอิเล็กตรอนในออร์บิทัลเหล่านี้ g-sublevel มี 9 ออร์บิทัล ดังนั้นในทางทฤษฎี มันสามารถมีอิเล็กตรอนได้ 18 ตัว h-sublevel อาจมี 11 ออร์บิทัลและสูงสุด 22 อิเล็กตรอน ในวงโคจร i-sublevel -13 และสูงสุด 26 อิเล็กตรอน ใน k-sublevel - 15 ออร์บิทัลและสูงสุด 30 อิเล็กตรอน
- จดจำลำดับของออร์บิทัลโดยใช้เคล็ดลับช่วยในการจำ:
NSโอเบอร์ NSนักฟิสิกส์ NSไม่ NSind NSiraffes NSiding ผมNS Kคัน (นักฟิสิกส์ที่มีสติไม่พบยีราฟซ่อนตัวอยู่ในห้องครัว)
- 4 ทำความเข้าใจกับเรกคอร์ดการกำหนดค่าทางอิเล็กทรอนิกส์ การกำหนดค่าทางอิเล็กทรอนิกส์จะถูกบันทึกเพื่อสะท้อนจำนวนอิเล็กตรอนในแต่ละออร์บิทัลอย่างชัดเจน ออร์บิทัลถูกเขียนตามลำดับ โดยจำนวนอะตอมในแต่ละออร์บิทัลจะถูกยกขึ้นทางด้านขวาของชื่อออร์บิทัล การกำหนดค่าทางอิเล็กทรอนิกส์ที่เสร็จสมบูรณ์จะอยู่ในรูปแบบของลำดับของการกำหนดระดับย่อยและตัวยก
- ตัวอย่างเช่น การกำหนดค่าทางอิเล็กทรอนิกส์ที่ง่ายที่สุด: 1s 2s 2p. การกำหนดค่านี้แสดงให้เห็นว่ามีอิเล็กตรอนสองตัวที่ระดับย่อย 1s อิเล็กตรอนสองตัวที่ระดับย่อย 2s และอิเล็กตรอนหกตัวที่ระดับย่อย 2p 2 + 2 + 6 = 10 อิเล็กตรอนทั้งหมด นี่คือโครงแบบอิเล็กทรอนิกส์ของอะตอมนีออนที่เป็นกลาง (เลขอะตอมของนีออนคือ 10)
- 5 จำลำดับของออร์บิทัล โปรดจำไว้ว่าออร์บิทัลของอิเล็กตรอนจะเรียงลำดับจากน้อยไปหามากของจำนวนเปลือกอิเล็กตรอน แต่จะเรียงตามลำดับพลังงานจากน้อยไปมาก ตัวอย่างเช่น ออร์บิทัล 4s ที่เติมมีพลังงานน้อยกว่า (หรือเคลื่อนที่น้อยกว่า) กว่า 3d ที่เติมบางส่วนหรือเต็ม ดังนั้น 4s ออร์บิทัลจะถูกบันทึกก่อน เมื่อคุณทราบลำดับของออร์บิทัลแล้ว คุณสามารถเติมออร์บิทัลตามจำนวนอิเล็กตรอนในอะตอมได้อย่างง่ายดาย ลำดับการเติมออร์บิทัลมีดังนี้: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p
- โครงแบบอิเล็กทรอนิกส์ของอะตอมที่เติมออร์บิทัลทั้งหมดจะมีรูปแบบดังนี้: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- โปรดทราบว่ารายการข้างต้น เมื่อเติมออร์บิทัลทั้งหมดแล้ว เป็นการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบ Uuo (ununoctium) 118 ซึ่งเป็นอะตอมที่มีหมายเลขสูงสุดในตารางธาตุ ดังนั้นการกำหนดค่าทางอิเล็กทรอนิกส์นี้จึงมีระดับย่อยทางอิเล็กทรอนิกส์ที่รู้จักในปัจจุบันทั้งหมดของอะตอมที่มีประจุเป็นกลาง
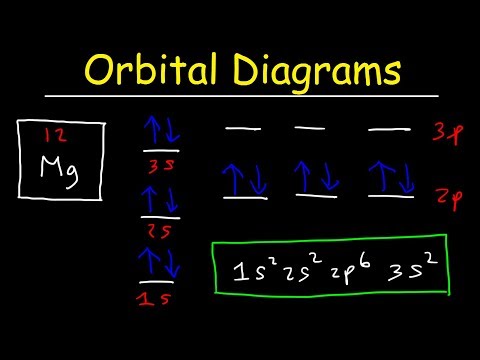
- 6 เติมออร์บิทัลตามจำนวนอิเล็กตรอนในอะตอมของคุณ ตัวอย่างเช่น หากเราต้องการจดโครงแบบอิเล็กทรอนิกส์ของอะตอมแคลเซียมที่เป็นกลาง เราต้องเริ่มด้วยการมองหาเลขอะตอมในตารางธาตุ เลขอะตอมของมันคือ 20 ดังนั้นเราจะเขียนโครงร่างของอะตอมที่มีอิเล็กตรอน 20 ตัวตามลำดับข้างต้น
- เติมออร์บิทัลตามลำดับด้านบนจนกว่าจะถึงอิเล็กตรอนที่ยี่สิบ ออร์บิทัล 1s แรกจะมีอิเล็กตรอนสองตัว ออร์บิทัล 2s ก็จะมี 2, 2p - six, 3s - two, 3p - 6 และ 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20 .) ใน กล่าวอีกนัยหนึ่ง การกำหนดค่าทางอิเล็กทรอนิกส์ของแคลเซียมคือ: 1 วินาที 2 วินาที 2 วินาที 3 วินาที 3 วินาที 4 วินาที
- โปรดทราบว่าออร์บิทัลอยู่ในลำดับของพลังงานจากน้อยไปมาก ตัวอย่างเช่น เมื่อคุณพร้อมที่จะย้ายไปยังระดับพลังงานที่ 4 ให้เขียนออร์บิทัล 4s ก่อนและ แล้ว 3d. หลังจากระดับพลังงานที่สี่ คุณจะไปที่ระดับที่ห้าซึ่งซ้ำลำดับเดิม สิ่งนี้เกิดขึ้นหลังจากระดับพลังงานที่สามเท่านั้น
- 7 ใช้ตารางธาตุเป็นเบาะแสภาพ คุณอาจสังเกตเห็นแล้วว่ารูปร่างของตารางธาตุสอดคล้องกับลำดับของระดับย่อยทางอิเล็กทรอนิกส์ในการกำหนดค่าทางอิเล็กทรอนิกส์ ตัวอย่างเช่น อะตอมในคอลัมน์ที่สองจากด้านซ้ายจะลงท้ายด้วย "s" เสมอ ในขณะที่อะตอมที่ขอบด้านขวาของส่วนตรงกลางแบบบางจะลงท้ายด้วย "d" เสมอ เป็นต้น ใช้ตารางธาตุเพื่อเป็นแนวทางในการเขียนการกำหนดค่า - เนื่องจากลำดับที่คุณเพิ่มลงในออร์บิทัลจะสอดคล้องกับตำแหน่งของคุณในตาราง ดูด้านล่าง:
- โดยเฉพาะอย่างยิ่ง คอลัมน์ซ้ายสุดสองคอลัมน์ประกอบด้วยอะตอมซึ่งการกำหนดค่าทางอิเล็กทรอนิกส์สิ้นสุดด้วย s-orbitals บล็อกด้านขวาของตารางประกอบด้วยอะตอมซึ่งมีการกำหนดค่าลงท้ายด้วย p-orbitals และในส่วนล่าง อะตอมจะสิ้นสุดด้วย f-orbitals
- ตัวอย่างเช่น เมื่อคุณจดการกำหนดค่าอิเล็กทรอนิกส์ของคลอรีน ให้คิดดังนี้: "อะตอมนี้อยู่ในแถวที่สาม (หรือ" คาบ ") ของตารางธาตุ นอกจากนี้ยังอยู่ในกลุ่มที่ห้าของ p orbital block ของระบบเป็นระยะ ดังนั้น การกำหนดค่าอิเล็กทรอนิกส์จะสิ้นสุดใน ..3p
- โปรดทราบ: องค์ประกอบในพื้นที่ของออร์บิทัล d และ f ของตารางมีลักษณะเป็นระดับพลังงานที่ไม่สอดคล้องกับช่วงเวลาที่พวกมันตั้งอยู่ ตัวอย่างเช่น แถวแรกของบล็อกขององค์ประกอบที่มี d-orbitals สอดคล้องกับ 3d orbitals แม้ว่าจะอยู่ในช่วงที่ 4 และแถวแรกขององค์ประกอบที่มี f-orbitals สอดคล้องกับ 4f orbital แม้ว่าจะมี อยู่ในช่วงที่ 6
- 8 เรียนรู้ชวเลขสำหรับการเขียนการกำหนดค่าอิเล็กทรอนิกส์แบบยาว อะตอมที่ขอบด้านขวาของตารางธาตุเรียกว่า ก๊าซมีตระกูล องค์ประกอบเหล่านี้มีความเสถียรทางเคมีมาก หากต้องการย่นขั้นตอนในการเขียนโครงแบบอิเล็กทรอนิกส์แบบยาว เพียงเขียนสัญลักษณ์ทางเคมีของก๊าซมีตระกูลที่ใกล้ที่สุดซึ่งมีอิเล็กตรอนน้อยกว่าอะตอมของคุณในวงเล็บเหลี่ยม จากนั้นจึงเขียนโครงร่างอิเล็กทรอนิกส์ของระดับการโคจรที่ตามมาต่อไป ดูด้านล่าง:
- เพื่อให้เข้าใจแนวคิดนี้ การเขียนตัวอย่างการกำหนดค่าจะเป็นประโยชน์ ลองเขียนการกำหนดค่าของสังกะสี (เลขอะตอม 30) โดยใช้ตัวย่อก๊าซมีตระกูล การกำหนดค่าสังกะสีที่สมบูรณ์มีลักษณะดังนี้: 1s 2s 2p 3s 3p 4s 3d อย่างไรก็ตาม เราเห็นว่า 1s 2s 2p 3s 3p เป็นโครงแบบอิเล็กทรอนิกส์ของอาร์กอน ซึ่งเป็นก๊าซมีตระกูล เพียงเปลี่ยนส่วนกำหนดค่าทางอิเล็กทรอนิกส์ของสังกะสีด้วยอาร์กอนสัญลักษณ์ทางเคมีในวงเล็บเหลี่ยม ([Ar])
- ดังนั้นการกำหนดค่าทางอิเล็กทรอนิกส์ของสังกะสีที่เขียนในรูปแบบย่อคือ: [อ.] 4s 3d.
- โปรดทราบว่าหากคุณกำลังเขียนโครงร่างอิเล็กทรอนิกส์ของก๊าซมีตระกูล เช่น อาร์กอน คุณไม่สามารถเขียน [Ar] ได้! เราต้องใช้การลดลงของก๊าซมีตระกูลที่หันหน้าไปทางธาตุนี้ สำหรับอาร์กอนจะเป็นนีออน ([Ne])
วิธีที่ 2 จาก 2: การใช้ตารางธาตุ ADOMAH
 1 เรียนรู้ตารางธาตุ ADOMAH วิธีการบันทึกการกำหนดค่าทางอิเล็กทรอนิกส์นี้ไม่ต้องการการท่องจำ อย่างไรก็ตาม มันต้องมีตารางธาตุที่แก้ไขแล้ว เนื่องจากในตารางธาตุแบบดั้งเดิม เริ่มจากคาบที่สี่ จำนวนคาบไม่ตรงกับเปลือกอิเล็กตรอน ค้นหาตารางธาตุ ADOMAH - ตารางธาตุชนิดพิเศษที่พัฒนาโดยนักวิทยาศาสตร์ Valery Zimmerman หาได้ง่ายด้วยการค้นหาสั้นๆ บนอินเทอร์เน็ต
1 เรียนรู้ตารางธาตุ ADOMAH วิธีการบันทึกการกำหนดค่าทางอิเล็กทรอนิกส์นี้ไม่ต้องการการท่องจำ อย่างไรก็ตาม มันต้องมีตารางธาตุที่แก้ไขแล้ว เนื่องจากในตารางธาตุแบบดั้งเดิม เริ่มจากคาบที่สี่ จำนวนคาบไม่ตรงกับเปลือกอิเล็กตรอน ค้นหาตารางธาตุ ADOMAH - ตารางธาตุชนิดพิเศษที่พัฒนาโดยนักวิทยาศาสตร์ Valery Zimmerman หาได้ง่ายด้วยการค้นหาสั้นๆ บนอินเทอร์เน็ต - ในตารางธาตุของ ADOMAH แถวแนวนอนแสดงถึงกลุ่มของธาตุ เช่น ฮาโลเจน ก๊าซมีตระกูล โลหะอัลคาไล โลหะอัลคาไลน์เอิร์ธ เป็นต้น คอลัมน์แนวตั้งสอดคล้องกับระดับอิเล็กทรอนิกส์และสิ่งที่เรียกว่า "น้ำตก" (เส้นทแยงมุมที่เชื่อมต่อบล็อก s, p, d และ f) สอดคล้องกับจุด
- ฮีเลียมถูกย้ายไปเป็นไฮโดรเจนเนื่องจากธาตุทั้งสองนี้มีวงโคจร 1 วินาที ช่วงบล็อค (s, p, d และ f) จะแสดงทางด้านขวา และหมายเลขระดับจะแสดงที่ด้านล่าง องค์ประกอบจะแสดงในกล่องหมายเลข 1 ถึง 120 ตัวเลขเหล่านี้เป็นเลขอะตอมทั่วไปที่แสดงจำนวนอิเล็กตรอนทั้งหมดในอะตอมที่เป็นกลาง
- 2 ค้นหาอะตอมของคุณในตาราง ADOMAH ในการบันทึกการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบ ให้ค้นหาสัญลักษณ์ในตารางธาตุ ADOMAH และขีดฆ่าองค์ประกอบทั้งหมดที่มีเลขอะตอมสูงกว่า ตัวอย่างเช่น หากคุณต้องการจดการกำหนดค่าอิเล็กทรอนิกส์ของเออร์เบียม (68) ให้ขีดฆ่าองค์ประกอบทั้งหมดจาก 69 เป็น 120
- สังเกตตัวเลข 1 ถึง 8 ที่ด้านล่างของตาราง เหล่านี้เป็นตัวเลขระดับอิเล็กทรอนิกส์หรือหมายเลขคอลัมน์ ละเว้นคอลัมน์ที่มีเฉพาะรายการที่ขีดฆ่าสำหรับเออร์เบียม คอลัมน์ที่มีหมายเลข 1, 2, 3, 4, 5 และ 6 ยังคงอยู่
- 3 นับระดับย่อยของวงโคจรกับองค์ประกอบของคุณ ดูที่สัญลักษณ์บล็อกที่แสดงทางด้านขวาของตาราง (s, p, d และ f) และหมายเลขคอลัมน์ที่แสดงที่ด้านล่าง ละเว้นเส้นทแยงมุมระหว่างบล็อกและแบ่งคอลัมน์ออกเป็นบล็อกคอลัมน์ตามลำดับจากด้านล่าง ไปด้านบน อีกครั้ง ให้ข้ามช่องที่มีองค์ประกอบทั้งหมดถูกขีดฆ่า จดบล็อกคอลัมน์โดยเริ่มจากหมายเลขคอลัมน์ตามด้วยสัญลักษณ์บล็อกดังนี้: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (สำหรับเออร์เบียม)
- หมายเหตุ: การกำหนดค่าทางอิเล็กทรอนิกส์ Er ด้านบนเขียนจากน้อยไปหามากของหมายเลขย่อยทางอิเล็กทรอนิกส์ นอกจากนี้ยังสามารถเขียนตามลำดับการเติมออร์บิทัล เมื่อต้องการทำสิ่งนี้ ให้ทำตามการเรียงซ้อนจากล่างขึ้นบน ไม่ใช่คอลัมน์เมื่อคุณเขียนบล็อคคอลัมน์: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f
- 4 นับอิเล็กตรอนสำหรับแต่ละระดับย่อยทางอิเล็กทรอนิกส์ นับองค์ประกอบในแต่ละบล็อก-คอลัมน์ที่ไม่ได้ขีดฆ่า โดยแนบอิเล็กตรอนหนึ่งตัวจากแต่ละองค์ประกอบ และเขียนหมายเลขถัดจากสัญลักษณ์บล็อกสำหรับแต่ละบล็อก-คอลัมน์ดังนี้: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... ในตัวอย่างของเรา นี่คือการกำหนดค่าทางอิเล็กทรอนิกส์ของเออร์เบียม
- 5 พิจารณาการกำหนดค่าทางอิเล็กทรอนิกส์ที่ไม่ถูกต้อง มีข้อยกเว้นทั่วไปสิบแปดข้อที่เกี่ยวข้องกับการกำหนดค่าทางอิเล็กทรอนิกส์ของอะตอมในสถานะพลังงานต่ำสุดหรือที่เรียกว่าสถานะพลังงานภาคพื้นดิน พวกเขาไม่เชื่อฟังกฎทั่วไปเฉพาะในสองหรือสามตำแหน่งสุดท้ายที่อิเล็กตรอนครอบครอง ในกรณีนี้ โครงแบบอิเล็กทรอนิกส์จริงจะถือว่าอิเล็กตรอนอยู่ในสถานะที่มีพลังงานต่ำกว่าเมื่อเปรียบเทียบกับโครงแบบมาตรฐานของอะตอม อะตอมข้อยกเว้น ได้แก่ :
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); โม (..., 4d5, 5s1); รุ (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); ลา (..., 5d1, 6s2); เซ (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); แอค (..., 6d1, 7s2); ไทย (..., 6d2, 7s2); ปะ (..., 5f2, 6d1, 7s2); ยู (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) และ ซม (..., 5f7, 6d1, 7s2).
เคล็ดลับ
- หากต้องการค้นหาเลขอะตอมของอะตอมเมื่อเขียนในรูปแบบอิเล็กทรอนิกส์ ให้บวกตัวเลขทั้งหมดที่ตามหลังตัวอักษร (s, p, d และ f) วิธีนี้ใช้ได้เฉพาะกับอะตอมที่เป็นกลางเท่านั้น หากคุณกำลังจัดการกับไอออน ก็จะไม่มีอะไรทำงาน - คุณต้องบวกหรือลบจำนวนอิเล็กตรอนส่วนเกินหรือสูญหาย
- ตัวเลขที่ตามหลังตัวอักษรเป็นตัวยก ห้ามทำผิดพลาดในเช็ค
- ไม่มี "ความเสถียรของระดับย่อยที่เติมครึ่งหนึ่ง" นี่คือการทำให้เข้าใจง่ายขึ้น ความเสถียรใด ๆ ที่เกี่ยวข้องกับระดับย่อย "เติมเต็ม" นั้นเกิดจากการที่แต่ละออร์บิทัลถูกครอบครองโดยอิเล็กตรอนหนึ่งตัว ดังนั้นแรงผลักระหว่างอิเล็กตรอนจึงลดลง
- อะตอมแต่ละอะตอมมีแนวโน้มที่จะมีเสถียรภาพ และการกำหนดค่าที่เสถียรที่สุดได้เติมเต็มระดับย่อย s และ p (s2 และ p6) ก๊าซมีตระกูลมีรูปแบบดังกล่าว ดังนั้นจึงไม่ค่อยเกิดปฏิกิริยาและตั้งอยู่ทางด้านขวาของตารางธาตุ ดังนั้น หากการกำหนดค่าสิ้นสุดที่ 3p จำเป็นต้องใช้อิเล็กตรอนสองตัวเพื่อให้อยู่ในสถานะที่เสถียร (หากต้องการสูญเสียหก รวมทั้งอิเล็กตรอนของระดับย่อย s จะต้องใช้พลังงานมากขึ้น ดังนั้นจึงสูญเสียสี่ได้ง่ายขึ้น) และหากการกำหนดค่าสิ้นสุดลงใน 4d ก็จะต้องสูญเสียอิเล็กตรอนสามตัวเพื่อให้อยู่ในสถานะเสถียร นอกจากนี้ ระดับย่อยที่เติมครึ่งหนึ่ง (s1, p3, d5 ..) มีความเสถียรมากกว่าตัวอย่างเช่น p4 หรือ p2 อย่างไรก็ตาม s2 และ p6 จะแข็งแกร่งยิ่งขึ้นไปอีก
- เมื่อคุณจัดการกับไอออน หมายความว่าจำนวนโปรตอนไม่เท่ากับจำนวนอิเล็กตรอน ในกรณีนี้ ประจุของอะตอมจะแสดงที่มุมขวาบน (ตามกฎ) ของสัญลักษณ์ทางเคมี ดังนั้น อะตอมพลวงที่มีประจุ +2 จึงมีโครงแบบอิเล็กทรอนิกส์ 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p โปรดทราบว่า 5p เปลี่ยนเป็น 5p ระวังเมื่อการกำหนดค่าของอะตอมเป็นกลางสิ้นสุดลงที่ระดับย่อยอื่นที่ไม่ใช่ s และ p เมื่อคุณหยิบอิเล็กตรอนขึ้นมา คุณจะเลือกได้เฉพาะจากเวเลนซ์ออร์บิทัล (s และ p orbitals)ดังนั้น หากการกำหนดค่าสิ้นสุดที่ 4s 3d และอะตอมได้รับประจุ +2 การกำหนดค่าจะสิ้นสุดที่ 4s 3d โปรดทราบว่า 3d ไม่ เปลี่ยนแปลงไป แทนที่จะสูญเสียอิเล็กตรอน s-orbital
- มีเงื่อนไขเมื่ออิเล็กตรอนถูกบังคับให้ "ไปสู่ระดับพลังงานที่สูงขึ้น" เมื่อระดับย่อยขาดอิเล็กตรอนไปครึ่งหนึ่งหรือเต็ม ให้นำอิเล็กตรอนหนึ่งตัวจากระดับย่อย s หรือ p ที่ใกล้ที่สุดแล้วย้ายไปยังระดับย่อยที่ต้องการอิเล็กตรอน
- มีสองตัวเลือกในการบันทึกการกำหนดค่าทางอิเล็กทรอนิกส์ สามารถเขียนเรียงจากน้อยไปมากของตัวเลขระดับพลังงานหรือในลำดับการเติมออร์บิทัลของอิเล็กตรอน ดังที่แสดงไว้ข้างต้นสำหรับเออร์เบียม
- คุณยังสามารถจดการกำหนดค่าทางอิเล็กทรอนิกส์ขององค์ประกอบโดยการเขียนเฉพาะการกำหนดค่าความจุ ซึ่งเป็นระดับย่อย s และ p สุดท้าย ดังนั้น การกำหนดค่าความจุของพลวงจะมีรูปแบบ 5s 5p
- โยนาห์ไม่เหมือนกัน มันยากกว่ามากสำหรับพวกเขา ข้ามสองระดับและทำตามรูปแบบเดียวกันขึ้นอยู่กับว่าคุณเริ่มต้นจากที่ใดและจำนวนอิเล็กตรอนมีจำนวนเท่าใด



