ผู้เขียน:
Lewis Jackson
วันที่สร้าง:
8 พฤษภาคม 2021
วันที่อัปเดต:
25 มิถุนายน 2024

เนื้อหา
สมการไอออนิกสุทธิเป็นส่วนสำคัญของเคมีเนื่องจากเป็นเพียงอนุภาคที่เปลี่ยนแปลงในปฏิกิริยาเคมี มักใช้ในปฏิกิริยาการลดออกซิเดชั่นปฏิกิริยาการเผาผลาญและปฏิกิริยาการทำให้เป็นกลางของกรด - เบส ขั้นตอนพื้นฐานในการเขียนสมการไอออนิกสุทธิมีสามขั้นตอน: ปรับสมดุลของสมการโมเลกุลแปลงเป็นสมการไอออนิกเต็มรูปแบบ (ขึ้นอยู่กับว่าสารแต่ละชนิดมีอยู่ในสารละลายอย่างไร) และสุดท้ายเขียนสมการไอออนิกสุทธิ
ขั้นตอน
ส่วนที่ 1 ของ 2: การทำความเข้าใจส่วนประกอบของสมการไอออนิก
รู้ความแตกต่างระหว่างโมเลกุลและ สารประกอบไอออนิก. ขั้นตอนแรกในการเขียนสมการไอออนิกสุทธิคือการกำหนดสารประกอบไอออนิกในปฏิกิริยา สารประกอบไอออนิกคือสารประกอบที่แยกตัวออกจากไอออนในสารละลายในน้ำและมีประจุไฟฟ้า สารประกอบโมเลกุลเป็นสารประกอบที่ไม่เคยมีประจุไฟฟ้า พวกมันถูกสร้างขึ้นระหว่างอโลหะสองชนิดและบางครั้งเรียกว่าสารประกอบโควาเลนต์
- สารประกอบไอออนิกสามารถเกิดขึ้นได้ระหว่างโลหะและอโลหะโลหะและไอออนพอลิอะตอมหรือไอออนหลายอะตอม
- หากคุณไม่แน่ใจว่าสารประกอบนั้นคืออะไรคุณสามารถมองหาองค์ประกอบในสารประกอบนั้นบนตารางธาตุ

รับรู้ถึงความสามารถในการละลายของสารประกอบ สารประกอบไอออนิกบางชนิดไม่สามารถละลายได้ในสารละลายในน้ำดังนั้นจึงไม่สามารถแยกตัวเป็นไอออนได้ คุณต้องระบุความสามารถในการละลายของสารประกอบแต่ละชนิดก่อนดำเนินการกับส่วนที่เหลือของสมการ ด้านล่างนี้เป็นบทสรุปของกฎสำหรับการละลาย ค้นหาแผ่นงานความสามารถในการละลายสำหรับข้อมูลรายละเอียดเพิ่มเติมและข้อยกเว้นที่ทราบสำหรับกฎเหล่านี้- ปฏิบัติตามกฎเหล่านี้ตามลำดับที่ระบุไว้ด้านล่าง:
- เกลือ Na, K และ NH ทั้งหมด4 ละลายทั้งหมด
- ไม่มีเกลือทั้งหมด3, ค2ซ3โอ2, ClO3และ ClO4 ละลายทั้งหมด
- เกลือ Ag, Pb และ Hg ทั้งหมด2 ละลายทั้งหมด
- เกลือ Cl, Br และ I ทั้งหมดละลายน้ำได้
- เกลือ CO ทั้งหมด3, O, S, OH, ป ณ4, CrO4, Cr2โอ7และอื่น ๆ3 จะละลาย (ยกเว้นในบางกรณี)
- เกลือทั้งหมด4 ละลายทั้งหมด (ยกเว้นในบางกรณี)
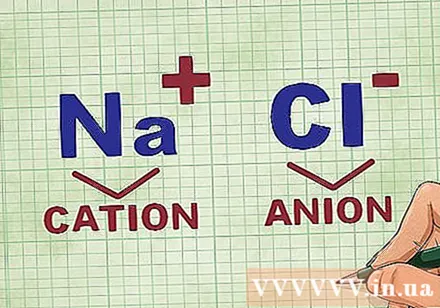
การกำหนดไอออนบวกและแอนไอออนในสารประกอบ ไอออนบวกเป็นไอออนบวกในสารประกอบและโดยปกติจะเป็นโลหะ แอนไอออนเป็นไอออนลบในสารประกอบและเป็นอโลหะ อโลหะบางชนิดสามารถสร้างไอออนบวกได้ แต่โลหะจะก่อตัวเป็นไอออนบวกเสมอ- ตัวอย่างเช่นใน NaCl Na คือไอออนบวกที่มีประจุบวกเนื่องจากเป็นโลหะและ Cl เป็นประจุลบที่มีประจุไฟฟ้าเนื่องจากเป็นอโลหะ

รับรู้ไอออนพอลิอะตอมในปฏิกิริยา ไอออนโพลีอะตอมเป็นโมเลกุลที่มีประจุซึ่งเกาะติดกันแน่นและไม่แยกตัวออกระหว่างปฏิกิริยาทางเคมี สิ่งสำคัญคือต้องรู้จักไอออนโพลีอะตอมเนื่องจากมีประจุเฉพาะและไม่แยกตัวออกจากกัน ไอออนโพลีอะตอมสามารถมีประจุบวกหรือลบ- หากคุณกำลังเรียนวิชาเคมีทั่วไปคุณมักจะต้องจำไอออนของ polyatomic ทั่วไป
- ไอออน polyatomic ทั่วไปบางชนิดคือ CO3, NO3, NO2, ดังนั้น4, ดังนั้น3, ClO4 และ ClO3.
- นอกจากนี้คุณยังสามารถค้นหาไอออนอื่น ๆ อีกมากมายในหนังสือเคมีหรือบนอินเทอร์เน็ต
ส่วนที่ 2 ของ 2: การเขียนสมการไอออนิกสุทธิ
สมดุลสมการโมเลกุล ก่อนที่จะเขียนสมการไอออนิกสุทธิคุณต้องแน่ใจว่าสมการโมเลกุลของคุณสมดุล ในการสร้างสมดุลให้กับสมการคุณต้องเพิ่มค่าสัมประสิทธิ์ที่ด้านหน้าของสารประกอบเพื่อให้เลขอะตอมของแต่ละองค์ประกอบเท่ากันทั้งสองด้านของสมการ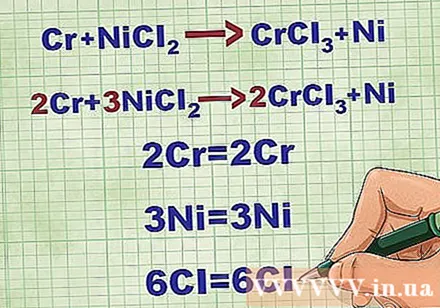
- เขียนจำนวนอะตอมที่ประกอบกันเป็นสารประกอบทั้งสองข้างของสมการ
- เพิ่มค่าสัมประสิทธิ์ด้านหน้าขององค์ประกอบอื่นที่ไม่ใช่ออกซิเจนและไฮโดรเจนเพื่อให้สมดุลในแต่ละด้าน
- ความสมดุลของอะตอมไฮโดรเจน
- สมดุลอะตอมของออกซิเจน
- นับจำนวนอะตอมในแต่ละด้านของสมการเพื่อให้แน่ใจว่าสมดุล
- ตัวอย่างเช่น Cr + NiCl2 -> CrCl3 + นิ สมดุลเป็น 2Cr + 3NiCl2 -> 2CrCl3 + 3 นิ.
ระบุสถานะของสารประกอบในสมการ หลายครั้งในปัญหามีคีย์เวิร์ดเพื่อแจ้งให้คุณทราบสถานะของแต่ละสารประกอบ มีกฎหลายประการที่จะช่วยกำหนดสถานะขององค์ประกอบหรือสารประกอบ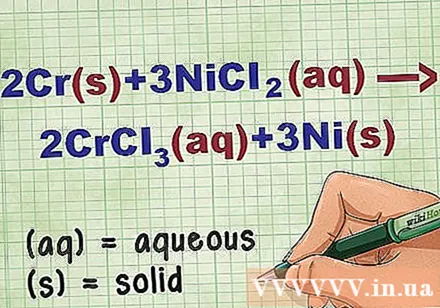
- หากไม่ได้ระบุสถานะขององค์ประกอบให้ใช้สถานะที่พบในตารางธาตุ
- ถ้าสารประกอบนั้นเรียกว่าสารละลายคุณสามารถเขียนเป็นน้ำหรือ (dd).
- หากมีน้ำอยู่ในสมการคุณต้องตรวจสอบว่าสารประกอบไอออนิกละลายน้ำได้หรือไม่โดยใช้สเปรดชีตการละลาย ถ้าความสามารถในการละลายสูงสารประกอบจะเป็นน้ำ (dd) ถ้าความสามารถในการละลายต่ำสารประกอบจะเป็นของแข็ง (ร).
- หากไม่มีน้ำสารประกอบไอออนิกจะเป็นของแข็ง (ร).
- หากปัญหาเป็นกรดหรือพื้นฐานแสดงว่าสารประกอบนั้นเป็นน้ำ (dd).
- ตัวอย่างเช่น 2Cr + 3NiCl2 -> 2CrCl3 + 3 นิ. รูปแบบองค์ประกอบของ Cr และ Ni อยู่ในสถานะของแข็ง NiCl2 และ CrCl3 สารประกอบไอออนิกสามารถละลายได้ดังนั้นจึงเป็นน้ำ เขียนสมการใหม่เป็น: 2Cr(ร) + 3NiCl2(dd) -> 2CrCl3(dd) + 3 นิ(ร).
พิจารณาว่าสารประกอบใดที่จะแยกตัวออก (แยกตัวเป็นไอออนบวกและแอนไอออน) ในสารละลาย เมื่อสารหรือสารประกอบแตกตัวจะแยกตัวออกเป็นไอออนที่มีประจุบวก (ไอออนบวก) และไอออนที่มีประจุลบ (แอนไอออน) นี่คือส่วนประกอบที่จะถูกปรับสมดุลที่ส่วนท้ายของสมการไอออนิกสุทธิ
- ของแข็งของเหลวก๊าซสารประกอบโมเลกุลสารประกอบไอออนิกที่ละลายได้ต่ำไอออนของพอลิอะตอมและกรดอ่อนจะไม่แยกตัวออกจากกัน
- สารประกอบไอออนิกมีความสามารถในการละลายสูง (ใช้ตารางความสามารถในการละลาย) และกรดแก่จะแตกตัวเป็นไอออน 100% (HCl(dd), HBr(dd), สวัสดี(dd), ซ2ดังนั้น4(dd), HClO4(dd)และ HNO3(dd)).
- หมายเหตุแม้ว่าไอออนโพลีอะตอมมิกจะไม่แยกตัวออกจากกันอีกต่อไป แต่หากเป็นส่วนประกอบของสารประกอบนั้น แต่ก็แยกตัวออกจากสารประกอบ
คำนวณประจุของแต่ละไอออนที่แยกตัวออกจากสารประกอบ โปรดจำไว้ว่าโลหะจะสร้างไอออนบวกและอโลหะจะสร้างไอออนลบ ใช้ตารางธาตุเพื่อกำหนดประจุขององค์ประกอบ คุณต้องสร้างสมดุลของประจุของแต่ละไอออนในสารประกอบ
- ในตัวอย่างนี้ NiCl2 แยกออกเป็น Ni และ Cl ในขณะที่ CrCl3 แบ่งออกเป็น Cr และ Cl
- Ni มีประจุ 2+ เนื่องจาก Cl มีประจุลบ แต่มี 2 อะตอม ดังนั้นเราต้องทำให้ Cl ไอออนลบ 2 ตัวสมดุลกัน Cr มีประจุ 3+ ดังนั้นเราจึงต้องปรับสมดุลของ Cl ไอออนลบ 3 ตัว
- โปรดจำไว้ว่าไอออนของพอลิอะตอมมีประจุเฉพาะ
เขียนสมการไอออนิกที่สมบูรณ์ สิ่งใดก็ตามที่แยกตัวออกหรือแตกตัวเป็นไอออน (กรดแก่) จะแยกออกเป็นสองไอออนแยกกัน สถานะของสารยังคงอยู่ (dd) แต่ให้แน่ใจว่าสมการยังคงสมดุล
- ของแข็งของเหลวก๊าซกรดอ่อนและสารประกอบไอออนิกที่ละลายได้ต่ำจะไม่เปลี่ยนสถานะหรือแยกตัวเป็นไอออน เราเก็บไว้เหมือนเดิม
- สารโมเลกุลจะกระจายตัวในสารละลายดังนั้นสถานะจึงเปลี่ยนเป็น (dd). สามข้อยกเว้น ไม่ใช่ กลายเป็น (dd) คือ: CH4(k), ค3ซ8(k)และ C8ซ18(ล).
- จากตัวอย่างข้างต้นสมการไอออนิกเต็มจะมีลักษณะดังนี้: 2Cr(ร) + 3 นิ(dd) + 6Cl(dd) -> 2Cr(dd) + 6Cl(dd) + 3 นิ(ร). เมื่อ Cl ไม่มีอยู่ในสารประกอบจะไม่ใช่สสารสองเฟสดังนั้นเราจึงคูณค่าสัมประสิทธิ์ด้วยจำนวนอะตอมในสารประกอบเพื่อให้ได้ Cl 6 ไอออนทั้งสองด้านของสมการ
ลบอิออนสมดุลโดยการยกเลิกไอออนเดียวกันในแต่ละด้านของสมการ คุณสามารถยกเลิกได้ก็ต่อเมื่อทั้งสองด้านเหมือนกันทุกประการ (ประจุเลขอะตอม ฯลฯ ) เขียนสมการใหม่โดยไม่มีสารที่ทำลายได้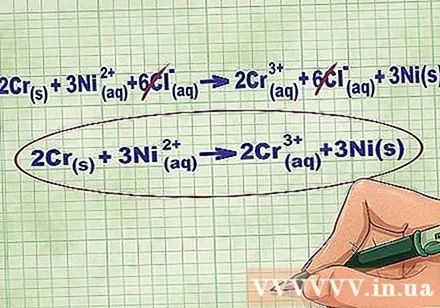
- หลังจากทำตัวอย่างเสร็จแล้วเรามีไอออนสมดุล Cl ที่ยกเลิกได้ 6 ตัวในแต่ละด้าน สมการไอออนิกสุทธิคือ 2Cr(ร) + 3 นิ(dd) -> 2Cr(dd) + 3 นิ(ร).
- ถ้าคุณถูกต้องประจุทั้งหมดที่ด้านของสารตั้งต้นควรเท่ากับประจุรวมที่ด้านผลิตภัณฑ์ในสมการไอออนิกสุทธิ
คำแนะนำ
- เขียนสถานะของสารทั้งหมดในสมการถ้าไม่ใช่คุณ จะ เสียแต้ม.



